أمراض الكلى في الكلية البشرية: المظاهر السريرية والعلاج
أمراض الكلى في الكلية البشرية: المظاهر السريرية والعلاج!
الكبيبات وآفات كبيبات:
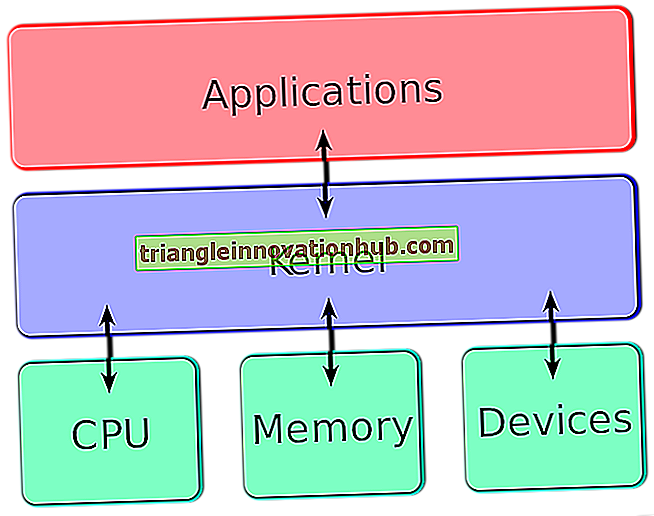
الكبيبة هي شبكة شعيرية معدلة. يعتمد معدل الترشيح الكبيبي (GFR) على تدفق الدم الكبيبي ، وضغط الترشيح الفائق ، ومساحة السطح.
تتحكم نغمة arteriolar incer و incerent في تدفق الدم وضغط الترشيح الفائق. تعتمد مساحة السطح الترشيح على انقباض الخلية السحائية. يتكون حاجز الترشيح الكبيبي من البطانة الكُبيانية الفينستية ، الغشاء القاعدي وعمليات القدم والأغشية الشقية للخلايا الطلائية الحشوية (podocytes). الخصائص الطبيعية للكيمياء والكهرباء الساكنة لحاجز الترشيح الكبيبي تمنع عادة ترشيح معظم بروتينات البلازما وكل خلايا الدم.
إصابة الكبيبة بأي طريقة تؤدي إلى ضعف الترشيح الكبيبي و / أو المظهر غير المناسب لبروتينات البلازما وخلايا الدم في البول. تسمى أمراض الكُبْرَة 'الأولية' عندما تقتصر أمراض المرض على الكلية ، وتعود السمات العامة للجهاز (مثل الوذمة وارتفاع ضغط الدم ومتلازمة اليوريمي) إلى خلل وظيفي في الكُبيبات.
عادةً ، ولكن ليس دائمًا ، يكون المصطلح الأساسي مرادفًا للمصطلح "مجهول السبب". تسمى أمراض الكبيبة "ثانوية" عندما تكون أمراض الكبيبة جزءًا من اضطراب متعدد الأجهزة. بشكل عام ، يشير المصطلح "حاد" إلى إصابة كبيبات تحدث على مدار أيام أو أسابيع.
يشير مصطلح "دون الحاد" أو "سريع التدريجي" إلى إصابة كبيبات خلال أسابيع أو بضعة أشهر. يشير مصطلح "مزمن" إلى الإصابة الكبيبية على مدى عدة أشهر أو سنوات. عندما تصيب الآفة أقل من 50٪ من الكبيبة ، يُقال أنها "بؤرية" وعندما يتأثر أكثر من 50٪ من الكبيبات ، يُقال أن الآفة "منتشرة". يستخدم مصطلح "قطعي" عندما تشمل الآفة جزءًا من الخصل الكُبيبي. يستخدم مصطلح "عالمي" عندما تنطوي الآفة على خصلة كُبيّة كاملة تقريبًا.
يشير مصطلح "التكاثري" إلى زيادة في عدد الخلايا الكبيبي ، والذي قد يكون نتيجة لتسلل الكريات البيض ، أو تكاثر الخلايا الكبيبية المقيمة. ويسمى انتشار الخلايا الكبيبية المقيمة باسم "intracapillary أو endo capillary" عند الإشارة إلى الخلايا البطانية أو مسراق الكبيبة. ويسمى انتشار الخلايا الكبيبيّة المقيمّة باسم "extracapillary" عند الإشارة إلى الخلايا في فضاء Bowman.
الهلال عبارة عن مجموعة من الخلايا على شكل نصف القمر في مساحة بومان. يتكون الهلال عادة من خلايا طلائية جدارية متكاثرة وحيدات متغلغلة. يتم تطبيق مصطلح "غشائي" على التهاب كبيبات الكلى التي يسيطر عليها توسيع الغشاء القاعدي الكبيبي (GBM) من قبل الودائع المناعية. يشير التصلب إلى زيادة في كمية المواد خارج الخلوية غير المتجانسة من نفس مظهر البنية التحتية والتركيب الكيميائي مثل GBM و mesangial matrix. يشير مصطلح "التليف" إلى ترسب الكولاجين من النوع الأول والنوع الثالث. التليف هو عادة نتيجة لشفاء الهلال أو التهاب tubulointerstitial.
آليات المناعة من الأمراض الكلوية:
أمراض الكلى المناعية بوساطة هي الأسباب الأكثر شيوعا لمرض الكلى في نهاية المرحلة (الداء الكلوي بمراحله الأخيرة).
يمكن أن يحدث تلف الكلى المناعي بواسطة الآليات التالية:
1. تعميم الودائع المجمعات (CICs) في الكبيبات ويؤدي إلى تلف الكبيبي.
2. في تشكيل معقد الموقع في الكبيبة والضرر الكبيبي لاحقة.
3. الأضرار الكلوية من خلال الأجسام المضادة السيتوبلازمية المضادة (ANCAs).
4. T خلية بوساطة الكلى.
الأضرار الكلوية التي كتبها CICs:
تتم إزالة CICs في الدورة الدموية بشكل فعال من قبل البروتينات مكملة. ومع ذلك ، يمكن لل CICs إيداع في كبيبات الكلى والأوعية الدموية الصغيرة ، أو الغشاء الزليلي من المفاصل وتسبب التهاب كبيبات الكلى ، التهاب الأوعية الدموية ، والتهاب المفاصل ، على التوالي. الأسباب وراء ترسب CICs في هذه المواقع غير معروفة. تؤدي المجمعات المناعية المودعة إلى تنشيط نظام المكمل وتؤدي إلى تراكم الخلايا الالتهابية في موقع الترسيب ؛ والوسطاء الذين تطلقهم الخلايا الالتهابية يتلفون الأنسجة في موقع الترسيب المناعي وينتج عن المرض.
ترسب CICs في الكلى النتائج في الأمراض البشرية التالية:
أنا. التهاب الكلية المصل المرض
ثانيا. Cryoglobulinemic glomerulphritis
ثالثا. بعد التهاب كبيبات الكلى المعدي
د. التهاب الكلية الذئبة
تشكيل مجمع المناعة في الموقع في الكلى:
ترتبط الأجسام المضادة في الدورة الدموية بالمستضدات في الكلية وتشكل مركبات مناعية في الموقع في الكلى: 1. المستضدات التي تكون جوهرية في الكلية (على سبيل المثال ، مستضد الكولاجين من النوع الثاني من GBM) ترتبط بالأجسام المضادة المنتشرة والشكل في الموقع المجمعات المناعية.
2. المستضدات التي تزرع في الكلى ربط مع الأجسام المضادة المتداولة وتشكيل في مجمع المناعي في الموقع.
وتكشف الدراسات المجهرية المناعية المباشرة (DIFM) عن نمطين من تلوين الأجسام المضادة المناعية في GBM.
1. تلطيخ مناعي خطي من GBM أو غشاء القاعدي أنبوبي (على سبيل المثال ، تلطيخ مناعي للمستضد الجوهرية من GBM من الأجسام المضادة غشاء القاعدي الكبيبي المضادة).
2. التلوين المناعي الحبيبي من GBM يشير إلى وجود مستضد متقطع على GBM (على سبيل المثال ، المستضدات التي تترسب في الكلية).
الأضرار الكلوية من خلال الأجسام المضادة السيتوبلازمية المضادة (ANCAs):
هناك نوعان من ANCAs ، ANCAs السيتوبلازمي (cANCAs) و ANCAs perinuclear (PANCAs). إن ورم حبيبي فيجنر ، متلازمة تشورج شتراوس ، والتهاب البولي المجهري هي أمراض التهاب الأوعية الدموية المرتبطة بوجود الـ ANCAs. غير معروف دور دقيق من ANCAs في التسبب في التهاب الأوعية الدموية في هذه الأمراض.
يتم اقتراح ANCAs لتسبب التهاب الأوعية الدموية من خلال الآليات التالية:
أنا. المستضدات الهدف (myeloperoxidase و proteinase- 3) من ANCAs هي جزيئات في سيتوبلازم العدلات. قد يؤدي تحفيز العدلات بواسطة السيتوكينات إلى التعبير عن المستضدات السيتوبلازمية المستهدفة على الأغشية السيتوبلازمية للعدلة. (لا يعرف سبب وآلية التحفيز السيتوكيني للعدلات والتعبير عن الميلوبيروكسيديز والبروتيز 3 على الغشاء السيتوبلازمي. يعتقد أن عدوى الفيروسات مسؤولة عن تحفيز السيتوكينات من العدلات.) يتفاعل ال ANCAs في الدورة الدموية مع مستضدات الميلوبيروكسيديز أو بروتيناز -3 المعبر عنها على سطح العدلات قد تؤدي إلى التصاق العدلات بالخلايا البطانية وحطام العدلات التي قد تؤدي إلى تفاعلات التهابية.
T Lymphocyte Mediated Renal Injury:
تشير الدراسات التي أجريت على نماذج حيوانية من التهاب الكلية الحلقية إلى أن الخلايا التائية قد تكون متورطة في التسبب في التهاب الكلية. سلالات من الفئران حساسة وراثيا تطوير شكل من أشكال الخلية من التهاب الكلية tubulointerstitial 6 إلى 7 أسابيع بعد التطعيم مع غشاء tubulointerstitial الأرنب (TBM). تقوم الفئران المحصنة بتطوير كل من الأجسام المناعية المضادة للـ TBM والمفاويات اللمفاوية TBM T. وينتج عن نقل الخلايا التائية (ولكن ليس المصل) من الفئران المحصنة إلى الفئران غير المحصنة تطور مرض الكلى في الفئران غير المحصنة.
مرض القبو المضاد للقياء:
يعد الطابق السفلي (antimlomerular basement) (anti-GBM) مرضاً من أمراض المناعة الذاتية النادرة حيث يتم توجيه الأضداد الذاتية الدورية ضد مستضد (نوع من الكولاجين الرابع) الموجود عادة في الغشاء القاعدي الكبيبي (GBM) ويحرض RPGN و GN المتوهن. متلازمة الالتهاب الكلوي الحاد أمر نادر الحدوث. 50 إلى 70 في المئة من مرضى مرضى GBM يعانون من نزيف رئوي. يشار عادة إلى المركب السريري لالتهاب الكلية المضادة للجراثيم GBM والنزيف الرئوي باسم "متلازمة Goodpasture".
بصرف النظر عن متلازمة جيد المراعى ، فإن الفشل الكلوي والنزف الرئوي تصادف في مجموعة متنوعة من الحالات ، والتي تشمل:
أنا. الفشل القلبي الحاد يعقد بواسطة الوذمة الرئوية (غالبًا ما تكون ملطخة بالدم) و آزوتيمية الكِرين.
ثانيا. الفشل الكلوي من أي سبب تعقّده فرط حجم الدم والوذمة الرئوية.
ثالثا. vasculatures بوساطة مجمع المناعي (مثل SLE، HSP، وغلوبيولين القري).
د. Pauci-immune vasculitides مثل Wegener's granulomatosis و الشرايين متعددة العقد nodosa.
v. العدوى مثل مرض Legionnaire
السادس. تجلط الأوردة الكلوية مع انسداد رئوي.
لذلك ، فإن الكشف عن الأجسام المضادة لـ GBM في مريض يعاني من الفشل الكلوي والنزف الرئوي أمر ضروري لتشخيص مرض مكافحة GBM.
إن مجال noncollagenous C-terminal (NCI) لسلسلة alpha-3 للكولاجين من النوع الرابع هو المستضد المستهدف لمرض مضاد GBM ويشار إلى هذا المجال بـ "قمة لاصقة جودبيتاستور". يتم التعبير عن حاتمة Goodpasture بشكل تفضيلي في الأغشية القبوانية الرئوية الكبيبية والرئوية.
حسابات مكافحة GBM GN عن 20 في المئة من حالات GN المتقدمة تدريجيا في البالغين وأقل من 10 في المئة من مثل هذه الحالات في الأطفال. إذا لم يتم علاج المرضى يموتون عادة بسبب الفشل الكلوي.
يمكن أن يحدث المرض في أي عمر. ومع ذلك ، يُنظر إلى توزيع ثنائي ، مع بلوغ الذروة 30 سنة من العمر و 60 سنة من العمر. عادة ما تحدث متلازمة المرعى الجيد عند الذكور الشباب (من 5 إلى 40 سنة) ونسبة الذكور إلى الإناث هي 6: 1. المرضى الذين يظهرون خلال الذروة الثانية في العقد السادس نادرا ما يكون لديهم نزيف رئوي.
طريقة تطور المرض:
غير معروف الزناد لفقدان التسامح لحصية Goodpature. قد يكون هناك استعداد وراثي ، كما اقترحت جمعية للمرض مع HLA- DRw2. تترابط الأجسام المضادة لـ GBM مع GBM مما يؤدي إلى تكملة التنشيط ، وتوظيف كريات الدم البيضاء اللاحقة وينتج عنه تكاثف جنيني متناثر ، انهيار جدار شعري كبيبي ، تسرب الفيبرين إلى تكوين بومان في الفضاء والهلال. في الرئتين ، تسلسل مماثل من الأحداث يعطل جدار الشعرية السنخية ويسبب نزف رئوي.
قد يكون سبب المرض عن طريق التعرض للسموم المستنشق (الهيدروكربونات ، أبخرة البنزين) أو العدوى. من المرجح أن يصاب المدخنون بالنزف الرئوي أكثر من غير المدخنين.
المظاهر السريرية:
معظم المرضى الذين يعانون من مرض مكافحة GBM يعانون من أمراض جهازية وإلتهاب كلى حاد أو تورط رئوي. قد يظهر بعض المرضى مع جميع الميزات الثلاث. يمكن أن يؤدي التورط الرئوي إلى بداية ظهور GN قبل عدة سنوات أو يمكن أن يتطور بعد الكشف عن التورط الكلوي.
أنا. المرضى الذين يعانون من حمى منخفضة الدرجة ، والصداع ، وفقدان الشهية ، والضيق ، والتقيؤ ، وفقدان الوزن ، والتعب.
ثانيا. تشمل أعراض التدخل الكلوي بيلة دموية ، قلة البول ، وذمة. فرط ضغط الدم غير عادي ويحدث في أقل من 20 في المائة من الحالات.
ثالثا. وتشمل أعراض التورم الرئوي ضيق التنفس والسعال ونقع البلغم الذي يتراوح من البلغم المتجمد بالدم إلى نفث الدم الضخم. قد يسبق نفث الدم الشعور بالدفء داخل الصدر.
د. ما يقرب من 30 في المئة من المرضى هم من ANCA إيجابية في بعض الأحيان خلال هذا المرض ، ومثل هؤلاء المرضى قد يكون طفح جلدي حكة وآلام مفصلية.
الدراسات المختبرية:
أنا. تحليل البول:
يحدث بيلة دموية مجهرية أو ميكروسكوبية. وينظر إلى الرواسب البولية الكلوية مع خلايا حمراء dysmorphic والخلايا الحمراء. تحدث بروتينية على مستوى أقل من المدى الكلوي.
ثانيا. دراسة المناعي يكشف عن وجود الأجسام المضادة المناعية GBM IGG. الكشف عن الأجسام المضادة للجسم المضاد لـ GBM هو جُرْبِيّ. ومع ذلك ، تظهر النتائج السلبية الزائفة في 10 إلى 40 في المئة من الحالات.
ثالثا. مقايسة المناعية المباشرة المرتبطة بالإنزيم باستخدام ألفا إنسان أصلي أو مؤلف من النوع ألفا -3 (نوع من الكولاجين الرابع) يكون مستضد NCI مثل الركازة اختبارًا أكثر حساسية وتحديدًا. النتائج السلبية الكاذبة أقل من 5 في المئة.
د. مستويات المكملة عادة ما تكون طبيعية. قد يكون 30 إلى 80 في المئة من المرضى لديهم مستوى C3 أقل من المعدل الطبيعي.
ضد ANCA:
30 في المئة من المرضى الذين يعانون من مرض مكافحة GBM هم ANCA إيجابية ؛ من بينها 75 في المئة من بنك اليابان الوطني الإيجابي و 25 في المئة من بنك كندا الوطني. من المرجح أن يستجيب المريض المصاب بمرض مضاد GBM مع إيجابية ANCA للعلاج.
السادس. عادة لا تكون الخزعة الكلوية مطلوبة لتشخيص مرض مضاد للجراثيم ، إذا تم الكشف عن وجود أجسام مضادة مضادة لـ GBM بالفعل. ومع ذلك ، فإن النتائج النسيجية مفيدة للعلاج وتقييم التكهن.
يكشف الفحص المجهري للضوء عن وجود جنين متكاثف منتشر مع الآفات والأهلة البؤرية في 50٪ من الكبيبات. IFM تكشف عن ترسيب شبيه خطي من IgG على طول GBM. تحدث رواسب C3 مماثلة في 70 في المئة من المرضى. (هناك فقط حالتين كلويتين أخريين مع تلطيخ IgG الخطي ، اعتلال الكلية السكري و التهاب كبيبات الكلى الليفية.) في بعض الأحيان ، تم العثور على ترسيب IgG على طول الغشاء القاعدي الأنبوبي والتهاب tubulointerstitial. يمكن رؤية الترسبات الخطية البؤرية والمتقطعة من IgG على طول الغشاء القاعدي السنخي الشعري.
السابع. دراسات التصوير من الصدر والكلى.
ويرتبط مرض مكافحة GBM بأمراض المناعة الذاتية الأخرى مثل الورم الحبيبي فيجنر ، والتهاب البولي المجهري ، وأمراض الغدة الدرقية ، ومرض الاضطرابات الهضمية ، وأمراض التهاب الأمعاء ، والأورام الخبيثة.
علاج او معاملة:
المرضى الذين يحتاجون إلى غسيل الكلى في العرض التقديمي نادرا ما يستردون وظائف الكلى. هناك حاجة للتسلسل مكافحة GBM لتقييم الاستجابة للعلاج. إن الانتكاسات ليست غير عادية ، كما أن ارتفاعات الأجسام المضادة المتصاعدة تبشر بانتكاسات. في المرضى الذين يعانون من الداء الكلوي بمراحله الأخيرة ، قد يكون مطلوبا زرع الكلى. يتم التعامل مع المرضى مع البلازما وعوامل مانعة للمناعة.
بشكل عام ، يتم تنفيذ البلازما في حالات الطوارئ يوميًا أو في أيام بديلة حتى لا يتم اكتشاف الأجسام المضادة لـ GBM في الدورة الدموية ، والتي قد تستغرق من أسبوع إلى أسبوعين. بدأ prednisone في وقت واحد مع سيكلوفوسفاميد أو الآزويثوبرين لقمع توليف جديد من الأجسام المضادة لمكافحة GBM. سرعة بدء العلاج أمر بالغ الأهمية في تحديد النتيجة.
قد تؤثر الأجسام المضادة لـ GBM في مريض يعاني من مرض مضاد GBM على الكلى الطبيعية المزروعة عند زراعة الكلى. إذا كانت الأجسام المضادة ضد GBM موجودة في مريض ، يجب تأجيل الزرع لمدة لا تقل عن 2 إلى 3 أشهر بعد اختفاء الأجسام المضادة في الدورة الدموية.
المرضى الذين يعانون من متلازمة ألبورت (الصمم الوراثي و GN) يفتقرون إلى حاتمة المراعي الجيدة على GBM. عند زرع الكلى الطبيعية لمريض مصاب بمتلازمة آلبورت ، يتعرف المريض على حواتم غودباستور الجيدة في كبيبات الكلى المزروعة كأجسام غريبة وينتج أجسام مضادة ضد حبيبات المرعى الجيدة ؛ ما يقرب من 50 في المئة من مرضى متلازمة آلبورت يطورون أضداد ضد GBM وبعض المرضى يعانون من فشل الطعم بسبب تطور الأجسام المضادة ضد GBM.
بعد التهاب كبيبات الكلى العقديات:
العرض السريري للالتهاب كبيبات الكلى الحاد بعد العقديات (APSGN) هو متلازمة الكلوية في كامل النبض مع الفشل الكلوي الحاد القلة. يتصف الجنين الحاد بعد الإصابات بالعقديات بالمظهر المفاجئ للبول الدموي ، البول البروتيني ، يلقي RBC في البول ، وذمة ، وارتفاع ضغط الدم مع أو بدون قلة البول. تم التعرف على هذا المرض باعتباره تعقيدًا لفترة النقاهة من الحمى القرمزية في القرن الثامن عشر.
المسببات:
سبب APSGN هو الالتهابات مع سلالات معينة من المجموعة A العقديات ، والمعروفة باسم سلالات nephritogenic.
أنا. يتبع APSGN الالتهابات الجلدية التي تسببها مجموعة A من العقديات نوع M 2 و 47 و 49 و 55 و 60 و 57.
ثانيا. يتبع APSGN عدوى الحلق التي تسببها مجموعة A من العقديات نوع M 1 ، 2 ، 3 ، 4 ، 12 ، 25 ، و 49. المناعة ضد سلالات بكتيرية السباعية النوعية هي محددة النوع ولفترة طويلة ، والعداوى المتكررة والتهاب الكلية نادرة. تشير العديد من سمات APSGN إلى أن المرض يتم بوساطة من قبل المجمعات المناعية. ومع ذلك ، لا يعرف طبيعة التفاعل بين الأجسام المضادة والمستضدات.
طريقة تطور المرض:
من المعتقد أن APSGN يحدث بسبب المجمعات المناعية التي تحتوي على المستضدات العقدية وأيضاً بسبب تفاعل المناعة الذاتية. يجري حاليا اختبار مستضديْن من العقديات nephritogenie فيما يتعلق بإمراضها في APSGN. لدى المستضدَين تقارب للجلومومون ، كما أنها تحفز استجابة الأجسام المضادة.
1. المولد المضاد للمكورات العقدية zymogen هو مقدمة من exotoxin B. غالبية المرضى APSGN لديها مستويات مرتفعة من الأجسام المضادة ل zymogen.
2. المستضد العقدي الثاني قيد الدراسة هو glyceraldehyde dehydrogenase الفوسفات (GADPH) المعروف أيضا باسم مولد المضاد (PA-Ag). الحقن الوريدي للمستضد PA يسبب وجود GN في الحيوانات. تم العثور على الأجسام المضادة لمستضد PA في معظم المرضى APSGN ، في حين أن الأجسام المضادة للمستضد PA هي منخفضة أو غير موجودة في العقدية غير المعقدة أو المرضى الذين يعانون من حمى الروماتيزم. مستضد PA ينشط المسار البديل لتفعيل تكملة.
يؤثر APSGN عادةً على الأطفال بين عامين و 12 عامًا. كلا الجنسين تتأثر على حد سواء.
المظاهر السريرية:
تاريخ مسبب للإصابة بالعدوى العقدية السابقة (مثل التهاب البلعوم ، التهاب اللوزتين ، أو تقيح الجلد) هو شرط لا غنى عنه لتشخيص APSGN. بشكل عام ، هناك فترة كامنة من 1 إلى 2 أسابيع بعد الإصابة بالحنجرة و 3 إلى 6 أسابيع بعد الإصابة بالجلد. [ظهور الأعراض والعلامات في نفس الوقت الذي يحدث فيه التهاب البلعوم (يُسمى أيضًا التهاب الكلية المزمن synpharyngetic) هو اعتلال الكلية IgA أكثر من APSGN.]
أنا. متلازمة الالتهاب الكلوي الحاد التي تظهر في شكل وذمة ، بيلة دموية ، وارتفاع ضغط الدم مع أو بدون قلة البول هي العرض الأكثر شيوعا من APSGN.
ثانيا. غالبًا ما يكون لون البول أو الشاي أو البول ذي اللون الكوكواني أول الأعراض السريرية ، وهو ما يرجع إلى انحلال الدم في كرات الدم الحمراء ، التي اخترقت الغشاء القاعدي الكبيبي وتم تمريرها إلى النظام الأنبوبي.
ثالثا. بيلة دموية.
د. الانتفاخ المفاجئ للوجه أو الجفون هو عرض شائع. الانتفاخ بارز عند الاستيقاظ ويميل إلى التهدئة في نهاية اليوم إذا كان المريض نشطًا. قد يكون لدى بعض المرضى وذمة معممة. العيب الكلوي في إفراز الملح والماء هو سبب وذمة.
v. الجناح أو آلام الظهر بسبب تورم الكبسولة الكلوية.
السادس. يحدث ارتفاع ضغط الدم في 60 إلى 80 بالمائة من المرضى وهو أكثر شيوعًا بين المرضى المسنين. قد يكون احتباس الملح والمياه هو سبب ارتفاع ضغط الدم. مع استعادة معدل الترشيح الكبيبي ، فقدان الوذمة وتطبيع حجم البلازما ، يعود ضغط الدم إلى طبيعته. إذا استمر ارتفاع ضغط الدم ، فإنه يشير إلى التقدم إلى مرحلة مزمنة أو قد لا يكون المرض APSGN.
السابع. يحدث اعتلال الدماغ ارتفاع ضغط الدم في 5 إلى 10 في المئة من المرضى وعادة ما تتحسن دون أي عقابيل عقابيل.
الثامن. تحدث قلة البول في 10 إلى 50 في المئة من الحالات وتشير إلى شكل هلال شديد من المرض. غالبًا ما يكون قلة البول عابرة ويحدث إدرار البول خلال أسبوع إلى أسبوعين.
التاسع. قد يحدث اختلال وظيفي في البطين الأيسر مع أو بدون ارتفاع ضغط الدم أو انصباب التامور خلال المراحل الاحتقالية الحادة والانتقائية.
الدراسات المختبرية:
التحقيقات المصلية ضرورية للتحقيق في الإصابة السابقة بالمكورات العقدية. يمكن الكشف عن الأجسام المضادة لمنتجات العقديات الخلوية الإضافية في حوالي 95 في المائة من مرضى التهاب البلعوم و 80 في المائة من المرضى المصابين بعدوى الجلد. تكون اختبارات الأجسام المضادة في المصل محددة نسبيًا ، بمعدل إيجابي كاذب بنسبة 5٪. ترتفع عترات الأجسام المضادة في المصل بعد أسبوع واحد من الإصابة ، وتصل إلى الذروة بعد شهر واحد ، وتعود إلى المستويات الطبيعية بعد عدة أشهر. العلاج بالمضادات الحيوية في وقت مبكر قد يمنع تطور استجابة الأضداد.
ا. إن مضاد الستربتوليسين O (ASO) ، ومضاد الستربتوكيناز (ASKase) ، والأدوية المضادة للنيكوتيناميد الأدينين النوكليوتيد (anti-NAD) ، و anti-hyaluronidase (AHase) ، والأجسام المضادة B-DNAse B إيجابية بشكل عام في المرضى الذين لديهم تاريخ من التهاب البلعوم.
ب. غالبًا ما يكون مضاد الدنا B و Anti-Ahase إيجابيين في المرضى المصابين بالتهابات الجلد بالعقديات.
ج. اختبار Streptozyme بالكشف عن ASO ، ومكافحة الحمض النووي ، ومكافحة AHase ، ومكافحة NAD.
د. تم الإبلاغ عن اختبار مضاد لل zymogen ليكون أكثر فائدة في تشخيص العدوى العقديات في المرضى الذين يعانون من GN.
ه. وترى عيارات عالية من الأجسام المضادة ل هيدروجيناز الفوسفات جليسركيرديهيد في APSGN.
F. CICs قابلة للاكتشاف في حوالي 60 في المئة من المرضى.
ز. 43 في المئة من المرضى الذين يعانون من APSGN هم إيجابيون ل RF.
ح. يوريا الدم والكرياتينين مرتفعة.
أنا. ينخفض مستوى CH50 ومصل C3 بشكل ملحوظ خلال أسبوعين في حوالي 90٪ من المرضى ،
ي. مستويات C4 طبيعية (مما يشير إلى تفعيل المسار البديل للتكامل). في بعض المرضى قد ينخفض C2 و C4 مما يشير إلى أن كلا من المسارات التقليدية والبديلة للتكملة هي المعنية. في معظم المرضى غير المصابين بمضاعفات ، تعود مستويات التكامل إلى طبيعتها في 6 إلى 8 أسابيع. تشير مستويات الاكتئاب المستمر بعد 8 أسابيع إلى احتمال وجود سبب آخر ، مثل وجود عامل كلوي C3 (قم بإحلال membrano proliferative GN).
ك. غالبية المرضى لديهم فرط غاماغلوبولين عابرة و cryoglobulinemia مختلطة.
ل. تحليل البول:
أنا. توجد الحمضيات و بروتينية في جميع الحالات. عادةً ما يتم حل "البلهاء" خلال 3 إلى 6 أشهر ، ولكن قد يستمر حتى 18 شهرًا. قد يتم الكشف عن بيلة دموية مجهرية في المرضى الذين تم علاجهم سريريا بالمرض.
ثانيا. تحتوي رواسب البول على كرات الدم الحمراء ، وألواح RBC ، و WBCs ، والطبقات المحببة.
ثالثا. حوالي 5 إلى 10 في المئة من مرضى APSGN لديهم بروتينية متعددة الكلى. يختفي البروتين عادة في 6 أشهر. المرضى الذين يعانون من بروتينية nephroticrange في المرحلة الحادة أو بروتينية ثقيلة مستمرة لديهم أسوأ من التوقعات.
م. خزعة الكلى:
عادة ما يتم تشخيص APSGN من خلال الخصائص السريرية والنتائج المصلية دون استعادة خزعة الكلى ، وخاصة في الأطفال الذين لديهم تاريخ نموذجي من عدوى العقديات. آفة المجهر الضوئي المميزة هي التهاب كبيبات الكلى التكاثري المنتشر.
الكبيبات هي خلايا مفرطة. يوجد عدد كبير من الكريات البيض متعددة الأشكال النووية وغالبا ما يشار إليها باسم نضحي GN. لا يوجد نخر في خصل كبيبي. عادة لا تتأثر إلا نسبة صغيرة من الكبيبات من الهلال. النبيبات طبيعية في معظم المرضى. قد تكون هناك قطرات زجاجية (قطرات إعادة امتصاص البروتين) في النبيبات الملتفة القريبة. تظهر المناطق الخلاليية الوذمة والتسلل مع الخلايا متعددة الخلايا وحيدة الخلية.
IFM:
في الخزعات الكلوية من المرضى الذين يعانون من 2 إلى 3 أسابيع من المرض ، وينظر إلى نمط حبيبي منتشر من رواسب IgG و C3 على طول جدار شعري كبيبي و mesangium. في حالة وجود كميات كبيرة من IgA ، يجب النظر في تشخيص بديل. تم وصف ثلاثة أنماط مختلفة للمناعة:
1. "نمط السماء المرصعة بالنجوم" هو نمط حبيبي ناعم غير منتظم مع رواسب صغيرة غالبًا ما تقع على الغشاء القاعدي الكبيبي الذي يعلو فوق مسراق. وغالبا ما ينظر إلى "نمط سماء نجمية" في المرحلة المبكرة من المرض.
2. يتميز "نمط المسراق" برواسب محببة من C3 مع أو بدون IgG ويرتبط هذا النمط ارتباطًا وثيقًا بنمط حل.
3. يتكون "نمط الحبال أو الأكاليل" من رواسب كبيرة ومكتظة بالدهون. يتوافق هذا النمط مع الحدبات الموجودة على الجانب الظاهر من الجدار الشعري الحبيبي على EM.
يُظهر Immune EM وجود رواسب مناعية ذات كثافة إلكترونية وكثيفة في الغشاء الكبيبي ، يشار إليها باسم "الحدب".
علاج او معاملة:
ينصح علاج الأعراض على أساس شدة سريرية لعلاج المرضى الذين يعانون من APSGN. خلال المرحلة الحادة ، يجب تقييد الماء والملح. الهدف من العلاج هو السيطرة على وذمة وارتفاع ضغط الدم. يتم إعطاء مدرات البول حلقة إذا تطور وذمة كبيرة أو ارتفاع ضغط الدم. إذا كانت مدرات البول غير كافية للسيطرة على ارتفاع ضغط الدم ، يمكن إعطاء حاصرات قنوات الكالسيوم أو مثبطات إنزيم المحول للأنجيوتنسين.
يستخدم النيتروسوبروسيد في الوريد للسيطرة على ارتفاع ضغط الدم الخبيث. يتم علاج فرط بوتاسيوم الدم واليوريا التي تهدد الحياة عن طريق غسيل الكلى. لا يشار عموما إلى الكورتيزون ، والعوامل المثبطة للمناعة ، و plasmapheresis. يجب علاج عدوى العقدية بالمضادات الحيوية. APSGN يحمل تشخيص ممتاز ونادرا ما يؤدي إلى نهاية مرحلة المرض الكلوي. قد توجد بيلة دموية مجهرية لمدة سنة واحدة بعد الإصابة الحادة ، ولكن قد يُترك البالغون يعانون من القصور الكلوي المتبقي.
الوفاة المبكرة نادرة جداً (أقل من 1٪) عند الأطفال ، ولكن في البالغين تبلغ نسبة الوفيات 25٪ ، وهي نسبة ثانوية لفشل القلب الاحتقاني وآزوتيمية.
يجب أخذ مسحات الحلق لأفراد العائلة والاتصال الوثيق ، وإذا اكتشفت الثقافات البكتيرية وجود العقديات المتسببة للكلى ، ينبغي التعامل مع الأفراد المعنيين بالبنسيلين عن طريق الفم أو الاريثروميسين (إذا كان لديهم حساسية من البنسلين) لمدة 7 إلى 10 أيام لمنع انتشار العقديات الكلوية على الآخرين.
Pauci-Immune التهاب كبيبات الكلى:
وأهم gn-immune GN هي:
أنا. مجهول السبب ، GN كلي محددة محدودة
ثانيا. التهاب الشرايين المجهرية العقدية
ثالثا. ورم حبيبي فيجنر
إن العرض السريري العام لـ pauci-immune GN هو RPGN وعلم الأمراض المعتاد هو necrotizing GN مع الهلالين التي تؤثر على أكثر من 50 في المئة من glomeruli (GN). ANCA قابل للاكتشاف في معظم المرضى.
التهاب كبيبات الكلى المجهول الكُلية مجهول السبب:
هذا الاضطراب هو أكثر شيوعا في منتصف العمر ولديه رجحان طفيف الذكور. عادة ما يظهر المرضى بميزات RPGN.
أنا. ANCA (عادة IGG PANCA) قابل للكشف في 70 إلى 90 في المئة من المرضى.
ثانيا. قد تكون مرتفعة مستويات ESR و CRP.
ثالثا. مستويات C3 طبيعية.
د. تعقّب المجمعات المناعية والأجسام المضادة لـ GBM ليست قابلة للاكتشاف.
v معظم المرضى لديهم أهلة على ضوء دراسة مجهرية لخزعة الكلى ، غالباً ما ترتبط بالـ GN. الودائع المناعية هزيلة أو غائبة. المجهر المناعي يكشف رواسب الفيبرين وفيرة داخل الهلال. هناك حاجة إلى العلاج العدواني مع الكورتيكوستيرويدات مع أو بدون سيكلوفوسفاميد أو الآزوثيوبرين.
اعتلال كبيبات الكلى الأساسي:
تكون كبيبات الكلى الأساسية هي أمراض الكبيبات التي تقتصر فيها أمراض المرض على الكليتين ، كما أن المظاهر النظامية للمرض هي نتيجة مباشرة للخلل الكُبيبي.
على نطاق واسع ، هناك خمسة عروض سريرية رئيسية من اعتلال كبيبات الكلى:
1. متلازمة الكلوية الحادة
2. التهاب كبيبات الكلى السريع التدريجي (RPGN)
3. متلازمة الكلوية
4. التشوهات اللاأعراضية للرواسب البولية (بيلة دموية ، بروتينية)
5. التهاب كبيبات الكلى المزمن.
متلازمة الكلوية الحادة:
متلازمة الالتهاب الكلوي الحاد هو الارتباط السريري للالتهاب الكبيبي الحاد. تتميز متلازمة الالتهاب الكلوي الحاد ببداية مفاجئة (على مدى أيام إلى أسابيع) من الفشل الكلوي الحاد وقلة البول (400 مل من البول / اليوم). أثناء الالتهاب الكبيبي الحاد ، تتسلل الخلايا الالتهابية إلى الكبيبة ، وهناك تكاثر الخلايا الكبيبية المقيمة.
هذه الأحداث تؤدي إلى إعاقة تجويف الشعرية الكبيبي وتؤدي إلى انخفاض تدفق الدم الكلوي و GFR. ينتج عن إصابة الجدران الشعرية الكبيبية النتائج البولية لخلايا الدم الحمراء ، خلايا الدم الحمراء ، خلايا الدم الحمراء المشوهة ، الكريات البيض ، بروتينية تحت حمراء من 3.5 جم / 24 ساعة (الرواسب البولية الكلوية).
التهاب كبيبات الكلى التكاثري هو الارتباط الباثولوجي لمتلازمة كلوية حادة. عندما تكون أكثر من 50 في المائة من الكبيبات متورطة ، فمن المعروف أن جنين الانتشابي الحاد منتشر. في الأشكال الأكثر اعتدالا للإصابة الكلوية ، قد يكون الانتشار الخلوي محصوراً في مسراق الكيسية ويعرف بالـ Mesangioproliferative GN. متلازمة الكلوية مع الفشل الكلوي القلة هو العرض الكلاسيكي للالتهاب كبيبات الكلى poststreptococcal.
التهاب كبيبات الكلى التقدمي السريع:
يتم تعريف التهاب كبيبات الكلى المتطور بسرعة (RPGN) على أنه أي مرض كبيبي يتميز بأهلة واسعة (عادة ما تكون> 50٪) كإكتشاف نسجي رئيسي وفقدان سريع لوظيفة الكلى (عادة انخفاض بنسبة 50٪ في معدل الترشيح الكبيبي خلال 3 أشهر) كما الارتباط السريري.
التهاب كبيبات الكلى السريع التدريجي (RPGN) هو الارتباط السريري لمزيد من التهاب الكبيبي تحت الحاد. يتطور الفشل الكلوي على مدى فترة تتراوح بين أسابيع وأشهر بالارتباط مع الرواسب البولية الكلوية ، وبروتينية تحت حمراء متغيرة وقلة البول المتغيرة ، ونزيف الغدد ، وذمة ، وارتفاع ضغط الدم. العلاقة الباثولوجية الكلاسيكية لـ RPGN هي التهاب كبيبات الكلى الهلالي. يتم تعريف الأهلة على أنها وجود طبقتين أو أكثر من الخلايا في مساحة بومان. وجود الهلال في كبيبات هو علامة من إصابة كبيباتية شديدة. المشاركون الرئيسيون في تكوين الهلال هي بروتينات التخثر ، والبلاعم ، والخلايا التائية ، والخلايا الليفية ، والخلايا الطلائية الجدارية.
أسباب RPGN:
1. المرض الكبيبي الأساسي: يصنف GN مجهول السبب أو الأساسي الهلال GN إلى 4 أنواع:
أنا. النوع الأول مع رواسب خطية من IgG (مرض مضاد GBM).
ثانيا. النوع الثاني مع رواسب محببة من الغلوبولين المناعي (معقد immune immune GN).
ثالثا. النوع الثالث مع عدد قليل أو لا ترسبات مناعية (pauci- immune).
A. ANCA-associated (التهاب الشرايين متعدد الأطياف الكلوي المحدود الكلوي)
ب ANCA سلبية.
د. النوع الرابع. مزيج من النوع الأول والنوع الثالث أ.
2. الأمراض المعدية [مثل الحشرات القشرية الحادة (APSGN) والتهاب الشغاف المعدي والتهاب الكلية التحليلي]
3. مرض متعدد الأنظمة (مثل SLE ، HSP ، الورم الحبيبي لـ Wegener ، غلوبيولين الدم المختلط الأساسي)
4. الأدوية (مثل البنسيلات ، هيدرالازين ، الوبيورينول ، ريفامبين)
5. فرضه أو مرض كبيبي أساسي آخر.
العرض السريري:
أنا. أعراض الضعف والغثيان والقيء (تدل على آزوتيمية) عادة ما تكون موجودة.
ثانيا. بعض المرضى الذين يعانون من علامات وأعراض مرض كلوي (على سبيل المثال ، فقر الدم ، بيلة دموية ، احتباس السوائل ، قلة البول ، أو يوريميا).
ثالثا. المرضى الذين يعانون من أعراض مسبباتهم الأساسية (مثل مرض الذئبة الحمراء ، متلازمة Goodpasture ، الورم الحبيبي لـ Wegener).
د. الوذمة المحيطية موجودة في 10 في المئة من المرضى.
v. قد يكون ضغط الدم طبيعي أو مرتفع قليلاً.
الدراسات المختبرية:
هناك حاجة إلى التشخيص السريع والعلاج الفوري لتجنب تطور الفشل الكلوي لا رجعة فيه. هناك حاجة إلى خزعة الكلى ودراسات المصل للتشخيص.
أنا. ESR عادة مرتفعة.
ثانيا. يوريا الدم ومستويات الكرياتينين مرتفعة.
ثالثا. تحليل البول:
تظهر بروتينية متواضعة (من 1 إلى 4 جم / يوم) ، بيلة دموية مجهرية ، كرات الدم الحمراء (RBCs) ، كرات الدم الحمراء (RBC) ، ويلقي WBC. نادرا ، قد تكون نتائج البول ضئيلة. عدم وجود الرواسب البولية النشطة لا يستبعد تشخيص RPGN.
د. قد تكون مرتفعة مستويات cryoglobulin المصل في cryoglobulinemia.
v. الخزعة الكينية عادة ما تكون مطلوبة لتشخيص RPGN من النوع الأول والثاني والثالث. نتائج الفحص المجهري المناعي من الأنسجة الخزعة الكلوية:
ا. وترد رواسب خطية من الجلوبيولين المناعي على طول GBM في مرض الغشاء القاعدي الكبيبي (GBM) المرض (RPGN من النوع الأول).
ب. رواسب محببة من الغلوبولين المناعي تظهر في النوع الثاني من RPGN.
ج. Paucity أو عدم وجود الغلوبولين المناعي هو سمة من سمات GNU-immune complex GN (RPGN type III).
السادس. التحقيقات المصلية مفيدة في تشخيص RPGN:
ا. 90 إلى 95 في المئة من المرضى الذين يعانون من مرض مكافحة GBM إيجابية للأجسام المضادة لمكافحة GBM. المرضى الذين يعانون من GBM عادة ما يكونون سلبيين للـ ANCA وتكون مستويات التكامل عادة طبيعية (RPGN type I).
ب. المرضى الذين يعانون من GN مجمع المناعي لديهم منخفضة C3 و C50 (90 ٪ من المرضى) وأنها سلبية بالنسبة للأجسام المضادة لمكافحة GBM و ANCA (RPGN من النوع الثاني).
ج. العديد من المرضى الذين يعانون من pnuci-immune GN لديهم دوران ANCA. المرضى الذين يعانون من مرض جنون المناعي لدى Pauci-immune سلبيون للأجسام المضادة لـ GBM وتكون مستويات متممة المصل طبيعية.
متلازمة الكلوية:
مصطلح "المتلازمة الكلوية" صاغه كالفن وغولدبرغ. متلازمة الكلوية هي مجمع سريري يتميز بعدد من الميزات الكلوية والكلية الإضافية. البروتينية هي السمة الأبرز للمتلازمة الكلوية. تنتج بروتين البول من النفاذية المعدلة لحاجز الترشيح الكبيبي للبروتين ، أي GBM و podocytes وأغشية الشق الخاصة بها. المكونات الأخرى للمتلازمة الكلوية هي ثانوية لفقدان بروتين البول ويمكن أن تحدث مع درجات أقل من بروتينية أو قد تكون غائبة حتى مع بروتينية ضخمة.
حاجز الترشيح المشحون سلبًا (والذي يتكون من جزيئات بروتيوجليكان من كبريتات الهيباران) يمنع عادةً ترشيح بروتينات البلازما الأنيمونية المنخفضة عبر GBM. في المرضى الذين يعانون من متلازمة الكلوية ، تركيز كبريتات الهيبارين في GBM منخفض وكميات كبيرة من البروتين عبر GBM وتفرز في البول.
بروتينات> 150 ملغم / 24 ساعة غير طبيعية ويمكن أن تنتج عن عدد من الآليات.
أنا. تنتج بروتينية الكبيبات من تسرب بروتينات البلازما من خلال حاجز ترشيح الكبيبي المقلق.
ثانيا. تنتج بروتينية الأنبوبية عن فشل إعادة استيعاب أنبوبي للبروتينات البلازمية ذات الوزن الجزيئي المنخفض التي يتم ترشيحها عادة ، ولكن تمت إعادة امتصاصها واستقلابها بواسطة الظهارة الأنبوبية. البروتينية الأنبوبية لا تتجاوز أبداً 2 جرام / 24 ساعة ، وبالتالي لا تسبب أبدًا المتلازمة الكلوية.
ثالثا. ينتج البروتين البروتيني الفائض عن ترشيح البروتينات ، وهي عادة السلاسل الخفيفة مناعي الجلوبيولين المناعي ، الموجودة في الدورة الدموية.
الميزة الأبرز للمتلازمة الكلوية هي بروتينية (> 3.0 إلى 3.5 جم / 24 ساعة) ، نقص ألبومين الدم ، وذمة ، فرط شحميات الدم ، lipduria ، وفرط التجلط. من وجهة النظر العلاجية ، يمكن تصنيف المتلازمة الكلوية على أنها حساسية للستيرويد ، أو مقاوِمة للستيرويد ، أو تعتمد على الستيرويد ، أو متلازمة كلائية متكررة.
تمثل الكيانات الستة التالية أكثر من 90٪ من حالات المتلازمة الكلوية عند البالغين.
1. الحد الأدنى لمرض التغيير (MCD)
2. التهاب كبيبات الكلى البؤري والقطعي (FSGS)
3. اعتلال كبيبات غشائي
4. MPGN
5. اعتلال الكلية السكري
6. الداء النشواني
الحد الأدنى من تغير المرض:
تم تسمية هذا المرض الحد الأدنى (MCD) لذلك لأن حجم وعمق كبيبي طبيعي عن طريق الفحص المجهري الخفيفة. MCD هو الشكل الأكثر شيوعًا لمتلازمة الالتهاب الكلوي عند الأطفال. يشير إلى آفة نسيجية في الكبيبة التي غالبا ما ترتبط بالمتلازمة الكلوية. يستأثر الـ MCD بحوالي 80 بالمائة من المتلازمة الكلوية لدى الأطفال الأصغر من 16 عامًا و 20 بالمائة لدى البالغين. ويعرف أيضا MCD باسم نخر الشحمية أو مرض عدم القدرة أو مرض عملية القدم. مسببات MCD غير معروفة.
أنا. معظم حالات MCD مجهولة السبب. من المفترض أن MCD هو اضطراب توسط خلوي T ، حيث ، cytokines خلية T تجرح عمليات القدم الظهارية الكبيبي. هذا ، بدوره ، يؤدي إلى انخفاض توليف polyanions ، التي تشكل حاجز الشحنة العادية لفلترة الجزيئات مثل الألبومين. وبالتالي ، يتأثر الترشيح الكبيبي ويتسرب الزلال في البول.
ثانيا. في 10 إلى 20 في المئة من المرضى ، قد يكون سبب MCD المخدرات (مضادات الالتهاب غير الستيروئيدية ، ريفامبين ، IFN ، الأمبيسيلين ، تريميثاديون) ، السموم (الزئبق ، الليثيوم ، لسعات النحل) ، العدوى (كريات الدم البيضاء المعدية ، فيروس نقص المناعة البشرية) ، التطعيمات ، والأورام (هودجكينز سرطان الغدد الليمفاوية ، سرطان ، الأمراض التكاثرية اللمفية الأخرى). ويتضاعف معدل الإصابة بمرض التصلب العصبي المتعدد أكثر من الأولاد مقارنة بالفتيات ، في حين أن التواتر في البالغين يكون متشابهاً عند كلا الجنسين. يبلغ الذروة ذروتها عند عمر سنتين ، ونحو 80٪ من الأطفال تقل أعمارهم عن 6 سنوات في وقت التشخيص.
المظاهر السريرية:
أنا. المرضى الذين يعانون من مرض التصلب العصبي المتعدد قد تحدث مع نقص حجم الدم ، وارتفاع ضغط الدم ، الجلطات الدموية ، أو العدوى.
ثانيا. الوذمة التابعة هي العلامة الأبرز.
ثالثا. عادة ما يكون ضغط الدم طبيعياً لدى الأطفال ، ولكن قد يرتفع ضغط الدم عند البالغين.
د. يؤدي الفقدان الشديد للبروتين في البول خلال فترة طويلة من الزمن إلى حالة من استنزاف البروتين مع هزال العضلات ، وترقق الجلد ، وفشل النمو.
عدد قليل جدا من المرضى الذين يعانون من MCD التقدم إلى الداء الكلوي بمراحله الأخيرة. أخطر مضاعفات MCD هي صدمة نقص حجم الدم. عادة ما تحدث صدمة نقص حجم الدم خلال مرحلة تكوين الوذمة من الانتكاس ويمكن أن يكون عجل من الإسهال ، تعفن الدم ، تصريف السائل الزاهد ، أو استخدام مدرات البول. أحداث Thromboembolic هي مضاعفات خطيرة من متلازمة الكلوية. قد يؤدي التجلط المحيطي إلى الإصابة بالغرغرينا وجلطة الأوردة العميقة في الساقين أو في عروق الحوض قد تؤدي إلى انسداد رئوي.
الدراسات المختبرية:
أنا. قد يكشف تحليل Urineanysis بطن بروتيني عميق وأجسام دهنية بيضاوية.
ثانيا. الزائد إلى نسبة تركيز الكرياتينين تزيد على 5.
ثالثا. مستوى ألبومين المصل منخفض. يتم تعريف متلازمة الكلوية في الأطفال من خلال الزلال في الدم أقل من 2.5 غرام / دل.
د. الدهون.
عادة ما تكون وظيفة الكلى طبيعية ، إلا في حالات FSGS غير المشخصة أو في الحالات ، والتي تتطور إلى الفشل الكلوي الحاد.
السادس. الدراسات المصلية (بما في ذلك الأجسام المضادة المعادية النووية ، مكملة ، و cryoglobulins) طبيعية.
السابع. بسبب ارتفاع معدل انتشار MCD في الأطفال الذين يعانون من متلازمة الكلوية ، وتجربة التجربة التجريبية من الكورتيزون حاول كخطوة أولى. يتم إجراء خزعة الكلى فقط في حالات مقاومة الستيرويد. عموما ، إذا بقيت بروتينية بعد الانتكاسات 2 أو دورات من المنشطات ، يتم إجراء خزعة الكلى قبل بدء العلاج السامة للخلايا أو المثبط.
حجم وعمق الكبيبي طبيعي أو شبه طبيعي في المجهر الضوئي. غالبًا ما تكون الجلوبيولينات المناعية والودائع المتممة سالبة بواسطة الفحص المجهري المناعي. تكشف الدراسة الميكروسكوبية الإلكترونية عن تراجع عمليات القدم الظهارية ، التي تم وصفها في الأدبيات القديمة كعملية دمج القدم.
علاج او معاملة:
يحدث المغفرة التلقائية في 30 إلى 40 في المائة من الأطفال المصابين بالـ MCD ، لكن المغفرة التلقائية أقل شيوعاً عند البالغين. الكورتيزون هو العلاج المختار من MCD في الأطفال والتشخيص ممتاز. بعد 8 أسابيع من الجلايكورتيكيد الفموي بجرعة عالية ، حوالي 90 في المائة من الأطفال و 50 في المائة من البالغين لديهم تخلف. الكبار يستجيبون ببطء أكثر من الأطفال. ينتكس متلازمة الكلوية في حوالي 50 في المئة من الحالات بعد انسحاب الجلايكورتيكيدات.
يتم علاج المرضى الذين يعانون من الستيرويد ، والمرضى الذين ينكسون بشكل متكرر مع عوامل مناعة. تستخدم مدرات البول لتقليل الوذمة الشديدة. يجب الوقاية من الجلطات الدموية عن طريق تعبئة المريض والاهتمام الدقيق بزوال الوريد وعمليات التسريب في الوريد.
التصلب الكبيبي البؤري والقطاعي مع رائحة الفم الكريهة:
غير معروف مسببات الكبيبات البؤري الأساسي والقطعي مع رائحة الفم الكريهة (FSGS). يظهر FSGS مجهول السبب على أنه متلازمة الكلوية (حوالي 66 ٪ من الحالات) أو بروتينية دون تعاطي (حوالي 33 ٪ من الحالات) مع ارتفاع ضغط الدم ، قصور كلوي معتدل ، ورواسب بول غير طبيعية تحتوي على كرات الدم الحمراء والكريات البيض. FSGS يمكن أن تعقد عددا من الأمراض الجهازية. قد تتطور FSGS بعد الفقدان المكتسب للنيفرون من الاجتثاث الجراحي الشامل للكتلة الكلوية.
الآفة المرضية الكلوية الوعائية في FSGS هي التصلب مع هيلينيسيس التي تتضمن أجزاء (قطعية) من أقل من 50 في المئة (بؤري) من كبيبات في نسيج خزعة كلوي.
الهدر العفوي لل FSGS الابتدائية أمر نادر الحدوث. ثمانية أسابيع من علاج الجلوكوكورتيكيد يحيل بروتينية في 20 إلى 40 في المئة من الحالات فقط. يحفز سيكلوفوسفاميد وسيكلوسبورين مغفرة جزئية أو مغفرة كاملة في 50 إلى 60 في المائة من المرضى الذين يستجيبون للستيروئيدات ، لكنهم عادة غير فعالين في الحالات المقاومة للستيرويد. البلازما لديها نجاح متغير في السيطرة على المتلازمة الكلوية.
بعد زرع الكلى ، 50 في المئة من الحالات تتكرر من FSGS في الطعم الخيفي وفقدان الكسب غير المشروع يحدث في 10 في المئة الحالات.
اعتلال كبيبات غشائي:
يدعى هذا المرض غشاء كبيبات الكُلى بسبب مظهر الضوء المجهري المميز للخزعة الكلوية ، أي السماكة المنتشرة في الـ GBM. سماكة منتشرة من GBM هو الأكثر وضوحا على تلطيخ شيف الحامضي (PAS) الدوري.
اعتلال كبيبات الكلى هي واحدة من الأشكال الأكثر شيوعا من متلازمة الكلوية في البالغين. يمكن أن يكون اعتلال كبيبات غشائي مجهول السبب أو ثانوي. يمكن تمييز هذين الشكلين بالميزات السريرية والمخبرية والنسجية.
ليس من المعروف أن التسبب في اعتلال كبيبات غشائي غشائي مجهول السبب. وهو مرض مناع مناع حيث تودع فيه المجمعات المناعية في الفضاء تحت الظهاري. يمكن أن تتطور المجمعات المناعية عن طريق تكوين معقدات مناعية في الموقع أو عن طريق ترسب مركبات CIC. غير معروفة المستضدات المشاركة في تطوير اعتلال كبيبات غشاء أولي. يمكن وضع المستضدات في الفضاء تحت الظهاري. العديد من المستضدات في اعتلال كبيبات الغشاء الثانوي غير معروفة أيضًا. تم العثور على المستضد السطحي لالتهاب الكبد B والمستضد التهاب الكبد E في رواسب المناعة ؛ تم التعرف على مستضدات الغدة الدرقية (في المرضى الذين يعانون من التهاب الغدة الدرقية) في الودائع.
وقد اقترح اكتشاف البولية C5b-C9 كاختبار لمتابعة نشاط المرض.
الأسباب:
يمكن أن تحدث الأشكال الثانوية من اعتلال كبيبات غشائي في أمراض المناعة الذاتية (مثل SLE ، والتصلب الجهازي ، والتهاب المفاصل الروماتويدي ، والتهاب الغدة الدرقية هاشيماتو) ، والأمراض المعدية (مثل التهاب الشغاف المعوي ، التهاب الكبد B ، التهاب الكبد C ، الجذام ، داء الخيطيات ، مرض العداري ، الملاريا ، داء البلهارسيات ، مرض الزهري) ، الورم الخبيث (مثل السرطان ، اللوكيميا ، الأورام اللمفاوية ، الورم الميلانيني) ، والمخدرات (كابتوبريل ، الذهب ، الليثيوم ، البنسيلامين ، البروبينسيد ، المركبات المحتوية على الزئبق).
اعتلال كبيبات الكلى هو السبب الرئيسي للمتلازمة الكلوية في البالغين (30 إلى 40 ٪) وسبب نادر في الأطفال (5 ٪). يتراوح معدل الذروة بين 30 إلى 50 سنة ، ونسبة الذكور إلى الإناث هي 2: 1. حوالي ثلث اعتلال كبيبات الكُلى الغشائي يحدث بالارتباط بأمراض جهازية مثل SLE ، عدوى التهاب الكبد B ، خباثة ، وعلاج بالعقاقير باستخدام الذهب و penicillamine.
المظاهر السريرية:
بداية المرض خبيثة وقد يظهر المرضى مع شكاوى غير محددة من فقدان الشهية ، والشعور بالضيق ، والتعب.
أنا. أكثر من 80 في المئة من المرضى الذين يعانون من متلازمة الكلوية ، وعادة ما تكون بروتينية غير انتقائية.
ثانيا. 50 في المئة من المرضى لديهم بيلة دموية مجهرية. لكن خلايا الدم الحمراء يلقي ، بيلة دموية العيانية ، والكريات البيضاء هي نادرة.
ثالثا. 10 إلى 30 في المئة من المرضى يعانون من ارتفاع ضغط الدم في البداية. مع الفشل الكلوي التدريجي ، يحدث ارتفاع ضغط الدم في العديد من المرضى.
الدراسات المختبرية:
أنا. البول: رواسب البول هو عادة كلية مع أجسام الدهون البيضاوي ويلقي الدهنية. Urinalyses من الحالات الخفيفة تكشف بروتينية دون العناصر المكونة في الرواسب
ثانيا. البولية C5b-C9.
ثالثا. مستويات متممة المصل.
د. ANAs ، والتهاب الكبد B ، serology ، والتهاب الكبد C ، والامعاء الزهري ، واختبارات cryoglobulins.
v الكشف عن الورم الخبيث.
السادس. خزعة الكلى:
يكشف الفحص المجهري الدقيق لنسيج الخزعة الكلوية عن سماكة منتشرة في GBM دون وجود دليل على وجود التهاب أو انتشار خلوي. يوضح التلوين الفضي طفرات مميزة على طول GBM ، والتي تمثل إسقاطات الغشاء القاعدي الجديد الذي يكتنف الرواسب المناعية تحت الظهارة.
يكشف IFM عن الترسب الحبيبي لـ IgC و C3 والمكونات النهائية للتكملة (C5b-C9) على طول الجدار الشعري الكبيبي. م: خلال المراحل المبكرة ، يمكن الكشف عن رواسب مناعية شبه ظهارية. ومع توسع هذه الرواسب ، تمتد تموجات الغشاء القاعدي الجديد بين الترسبات المناعية وتغمر الرواسب. مع مرور الوقت ، تُحاط الترسبات بالكامل وتُدمج في الغشاء القاعدي.
في 40 في المئة من المرضى الذين يعانون من اعتلال كبيبات غشائي ، يتحول متلازمة الكلوية بشكل تلقائي وكلي. حوالي 30 إلى 40 في المئة من المرضى لديهم تكرار الانتكاسات والتخلي. 10 إلى 20 في المئة من المرضى يعانون من انخفاض تدريجي بطيء في GFR والتقدم إلى ESRD بعد 10 إلى 15 سنة.
علاج او معاملة:
فشل الكورتيكوستيرويدات في إظهار تحسن مستمر في بروتينية أو حماية كلوية. وقد أفادت الدراسات غير المنضبط أن سيكلوفوسفاميد ، chlorambucil ، والسيكلوسبورين تقلل بروتينية و / أو بطء انخفاض في GFR في المرضى الذين يعانون من مرض التدريجي. للمرضى الذين يعانون من الداء الكلوي بمراحله الأخيرة ، يعتبر زرع الكلى خيارًا آخر. العلاج الناجح للسبب الأساسي قد يعالج المريض مع اعتلال كبيبات غشائي ثانوي.
التهاب الغشاء الكظري المشيمي الغشائي
Membrano التهاب الكلية الكبيبي التكاثري (MPGN) هو سبب غير مألوف لالتهاب الكلية المزمن الذي يحدث في المقام الأول في الأطفال والشباب البالغين. يعرف MPGN أيضًا باسم mesangiocapillary GN. يتميز MPGN بسماكة GBM والتغيرات التكاثرية.
تتضمن السمات النسيجية لـ MPGN ما يلي:
1. انتشار خلايا مسراق الكبيبة والبطانية وتوسيع المصفوفة مسراق الكبيبة.
2. سماكة الجدران الشعرية الطرفية عن طريق الترسبات المناعية تحت البطانة و / أو الرواسب الكثيفة.
3. مداخل بين قوسين في جدار الشعيرات الدموية ، مما أدى إلى ظهور كفاف مزدوج أو ظهور مسار الترام على المجهر الضوئي.
ينقسم MPGN إلى MPGN مجهول السبب و MPGN ثانوي.
أنا. يتم تصنيف MPGN مجهول السبب إلى 3 أنواع ، النوع الأول ، النوع الثاني ، والنوع الثالث على أساس المظهر الجانبي المتكامل ، وتلطيخ مناعي ، والمظهر الهيكلي الفائق لنسيج الخزعة الكلوية. المظاهر الضوئية المجهرية والعروض السريرية للأنواع الثلاثة من MPGN مجهول السبب متشابهة تقريبًا ؛ ولكن هناك اختلافات في آليات تكملة التنشيط والاستعداد لتكرار عمليات زرع الكلى. لم يتم الإبلاغ عن التحويل من نوع إلى آخر.
ثانيا. يعد MPGN الثانوي أكثر شيوعًا من MPGN مجهول السبب ويتم تشخيصه من خلال الخصائص السريرية والدراسات المختبرية ودراسات الخزعة الكلوية.
ترتبط الشروط التالية مع MPGN الثانوية:
ا. أمراض المناعة الذاتية:
SLE ، متلازمة Sjogren ، والتهاب المفاصل الروماتويدي ، وأوجه القصور الموروثة ، خاصة ، نقص Cj ، تصلب الجلد ، ومرض الاضطرابات الهضمية.
ب. الالتهابات: التهاب الكبد B ، التهاب الكبد C ، التهاب الشغاف البكتيري ، التحويلة المصابة بالبكتيريا (البكتيرية) ، الملاريا ، البلهارسيا ، والميكوبلازما.
ج. المزمنة والأوعية الدموية الخثارية المزمنة.
د. أمراض ترسب الباراروتين:
Waldenstrom macroglobulinemia ، GN المرتبطة بالجلوجلوبين الدم من النوع الأول ، اعتلال كبيبات الكلى المناعي ، سلسلة خفيفة مناعي الجلوبيولين أو مرض ترسب السلسلة الثقيلة ، التهاب كبيبات الكلى الليفية.
ه. الأورام الخبيثة:
سرطان الغدد الليمفاوية ، سرطان الدم ، سرطان.
نقص التنسج الدموي في MPGN:
يتم وصف المسارات الكلاسيكية والبديلة لتفعيل تكملة في. Hypocomplementemia هو نتيجة مميزة في جميع الأنواع الثلاثة من MPGN مجهول السبب. حوالي 75 في المئة من مرضى MPGN لديهم مستويات منخفضة من C3.
يتم وصف ثلاثة أجسام مضادة كلوية في MPGN. ليست معروفة أسباب تطوير هذه الأجسام المضادة. قد تكون هذه الأجسام المضادة مسؤولة عن نقص إفراز الدم في MPGN.
1. العامل الكلوي للمسار الكلاسيكي (NFc أو C4NeF):
NFc يستقر في المسار الكلاسيكي C3 convertase (C4b2a). لا تتسبب NFc في تحويل C3 ما لم يتم إنتاج C4b2a.
2. العامل الكلوي لحلقة التضخيم (NFa أو C3NEF):
NFa هو جسم مضاد لـ C3bBb. ربط NFa بـ CSbBb يثبّت المعقد ويمنع تدهوره بمُنشطاته العادية ؛ وبالتالي ، يتم تنشيط نظام المكمل مع الاستهلاك المزمن من C3 ، مما يؤدي إلى انخفاض مستوى C3.
3. العامل الكلوي للمسار الطرفي (NFt): يقوم NFt بتثبيت المسار البديل C3 / C5 convertase ويؤدي إلى تنشيط C3.
نوع MPGN 1:
ما يقرب من 33 في المئة من المرضى الذين يعانون من النوع 1 MPGN لديهم CICs. تم العثور على رواسب معقدة مناعية في الفضاء مسراق الكواكب والفضاء السفلي. قد تؤدي المجمعات المناعية المودعة في الكبيبة إلى تنشيط المكمل مما يؤدي إلى تدفق الخلايا الالتهابية. والسيتوكينات التي تطلقها الخلايا الالتهابية قد تؤدي إلى انتشار mesangial و endothelial. تم العثور على عامل الكلوي من المسار الكلاسيكي (NFc) في حوالي 15 في المئة من المرضى.
يستقر NFc على المسار الكلاسيكي C3 convertase ويؤدي إلى تنشيط C3. ومع ذلك ، فإن دور NFC في التسبب في النوع الأول MPGN غير معروف. قد يتسبب تنشيط المكمل الناتج عن نقص تنفيس الدم في خلل خلل في CICs. ما يقرب من 20 في المئة من المرضى لديهم عامل الكلوي من مسار المحطة.
MPGN النوع الثاني:
يعرف النوع الثاني من MPGN أيضًا بمرض الودائع الكثيفة. السمة المميزة للنوع II MPGN هي وجود رواسب كثيفة الإلكترونات داخل GBM وأغشية القبو الكلوية الأخرى (التي تظهر من قبل EM) التي تلوث لـ C3 ، لكن القليل من الجلوبيولين المناعي أو لا. النوع الثاني MPGN هو مرض جهازي كما يتضح من الترسبات الكثيفة في الكلى ، الجيوب الأنفية الطحالية ، وغشاء بروتش الشبكي. هذا المرض له نسبة عالية من تكرار في allografts الكلوي. التركيب الكيميائي للرواسب الكثيفة غير معروف. لا يتم ملاحظة CICs في النوع II MPGN.
العامل الكلثي في حلقة التضخيم (NFa) موجود في 80 في المئة من المرضى الذين يعانون من النوع الثاني من MPGN. تقوم NFa بتثبيت مسار التحويل البديل البديل وينتج عن ذلك تفعيل تكملة واستهلاك C3 مزمن.
يرتبط ضمور الشحميات الجزئية (PLD) عادة بنوع MPGN II ووجود NFa.
تنتج الخلايا الدهنية adipsin (Adipsin مماثل للعامل D الموسع وينشط C3bBb). NFa يسبب تحلل من adiposytes. يؤثر ضمور الدهون عادة على الطرف العلوي والجذع والوجه.
نوع MPGN III:
تحتوي الترسبات الحبيبية في النوع الثالث من MPGN على C3 و C5 و properdin ، مما يشير إلى تنشيط المسار البديل للتكملة. لا يبدو CICs للعب دور في التسبب في نوع III MPGN. العامل الكلوي من المسار الطرفي (NFt) موجود في 60 إلى 80 في المئة من المرضى الذين يعانون من النوع الثالث من MPGN. تقوم NFt بتثبيت المسار البديل C3 / C5 convertase وتقوم أيضًا بتنشيط مكونات طرف المحطة الطرفية التي تشكل C5b-C9 (هجوم الغشاء) المعقدة.
إن MPGN من النوع I مع المتلازمة الكلوية هو مرض تقدمي مع 50 بالمائة من المرضى الذين يصابون بـ ESRD بعد 10 سنوات. النوع الثاني من MPGN هو أكثر عدوانية بشكل عام من النوع الأول MPGN ولديه فترة بقاء كلوي متوسط من 5 إلى 12 سنة.
المظاهر السريرية:
قد يظهر المرضى الذين يعانون من MPGN مع بروتينية عديمة الأعراض و بيلة دموية يتم اكتشافها في تحليل البول الروتيني ، متلازمة الكلوية ، متلازمة الالتهاب الكلوي الحاد ، نوبات متكررة من بيلة دموية إجماليّة ، أو آزوتيمية.
أنا. ما يقرب من 80 في المئة من المرضى يعانون من ارتفاع ضغط الدم في العرض الأولي.
ثانيا. يشير اكتشاف drusen في مريض مع GN مزمن إلى MPGN من النوع II (Drusen هي رواسب صفراء من خارج الخلية التي توجد بين الغشاء القاعدي لظهارة الصباغ الشبكية والمنطقة الكولاجينية الداخلية لغشاء Bruch).
الدراسات المختبرية:
أنا. تحليل البول:
Hematuria مع خلايا حمراء dysmorphic ، يلقي RBC. بروتينية؛ انخفاض معدل الترشيح الكبيبي وينظر في 20 إلى 50 في المئة من المرضى.
ثانيا. الملف الشخصي المكمّل:
ا. نوع MPGN الأول:
مستويات C3 منخفضة في حوالي 50 في المئة من المرضى. دلائل على تفعيل مسار تكملة الكلاسيكية (منخفضة C4 ، C2 ، C1q ، C3) قد تكون المكونات التكميلية الطرفية C5 و C8 و C9 منخفضة أو ضمن النطاق الطبيعي. قد تكون NFc (C4NeF) أو NFt موجودة.
ب. نوع MPGN الثاني:
مستويات C3 منخفضة في 70 إلى 80 في المئة من المرضى
مكونات مكملة مبكرة ومركبة ضمن النطاق الطبيعي.
NFa (C3NeF) موجود في أكثر من 70 في المئة من المرضى. - النوع الثالث من MPGN:
انخفضت مستويات C3 في 50 في المئة من المرضى. مكونات المكونات الطرفية منخفضة ، خاصة إذا تم تقليل C3 بشكل ملحوظ. مستويات Clq و C4 هي ضمن النطاق المرجعي NFa غير موجودة ، ولكن NFt موجودة في 60 إلى 80 في المئة من الحالات.
قد ترتفع عيارات ASO في ما يصل إلى 50 في المئة من المرضى في العرض التقديمي.
ثالثا. هناك حاجة إلى خزعة الكلى للحصول على تشخيص MPGN.
نوع MPGN الأول:
يتكون شكل الغشاء القاعدي الجديد غير المنتظم حول الرواسب تحت البطانية وتوقعات مسراق الكالم ، مما يؤدي إلى ظهور مسار الترام على الفحص المجهري الضوئي. يظهر المجهر المناعي رواسب C3 الحبيبية البارزة في الجدران الشعرية ، مع رواسب Ces متغير المسراق C3.
يمكن العثور على مكونات مكملة مبكرة ، IgG ، وأقل استخدامًا لـ IgM مع توزيع مشابه لـ C3. EM: وجود رواسب إلكترون كثيفة في المواقع تحت البطانية هي خاصية من نوع MPGN 1. قد توجد أيضًا رواسب ظهارية فرعية من حين لآخر.
MPGN من النوع 11:
الغشاء القاعدي للكبيبة. يتم تكثيف كبسولة بومان والنبيبات ، والشعيرات الأنبوبية الأنبوبية. يحتوي الغشاء القاعدي على شريط غير منتظم يشبه البقع الخاصة (PAS stain). يكشف الفحص المجهري المناعي عن ترسيب C3 في نمط غير منتظم في الأغشية القاعدية على كلا الجانبين ولكن ليس داخل الترسبات الكثيفة أو في أشكال حلقة عقيدية في المسنجيوم. رواسب الجلوبيولينات المناعية غائبة أو هزيلة في الكبيبة.
EM:
يتم تسخين الغشاء القاعدي بواسطة رواسب كثيفة متقطعة وغير متبلرة موجودة في طبقة الصفيح الكثيفة. ويمكن أيضا أن ينظر إلى الرواسب الكثيفية الظهارية والوزانية.
نوع MPGN IB:
المناعي يظهر ترسب الحبيبية من C3 ، C5 ، properdin ، IgG ، و IgM ، في الغالب في الجدران الشعرية. EM: ورم ظهاري الفرعية ، البطانية ، ورواسب مسراق الكبيبة. الغشاء القاعدي لديه مظهر مغلفة معقدة.
علاج او معاملة:
لم يتم تحديد العلاج الأمثل ل MPGN مجهول السبب بشكل واضح. العلامات المصلية لتقييم نشاط المرض غير متوفرة. تثبيط المناعة والأسبرين والديبيريدامول لمنع الإصابة بفعل الصفيحات ، مضادات التخثر للحد من ترسب الليفين الكبيبي ، والأدوية الستيرويدية وغير الستيرويدية المضادة للالتهاب لمنع التهاب هي التدابير العامة للعلاج. ومع ذلك ، فإن هذه التدابير لها فوائد ضئيلة وترتبط بآثار جانبية حادة. الستيرويدات القشرية فعالة في الأطفال والعلاج المضادة للصفيحات مفيد في البالغين. يجب أيضًا معالجة السبب الكامن وراء MPGN الثانوي.
اعتلال كبيبات الكريات الليفية
اعتلال كبيبات الليفية المناعي الليفي هو كيان إيكولوجي مسبب للاكتئاب ، ويمثل 1 في المائة من التشخيصات في معظم سلسلات الخزعة الكلوية الكبيرة. مسببات المرض غير معروفة.
أنا. جميع المرضى الذين يعانون من بروتينية و> 50 في المئة لديهم متلازمة الكلوية.
ثانيا. غالبية المرضى لديهم أيضا بيلة دموية ، وارتفاع ضغط الدم ، والقصور الكلوي.
يختلف المظهر المجهري الخفيف للخزعة الكلوية من تمدد مسراق الكبيبة وسماكة الغشاء القاعدي بمواد PAS الإيجابية إلى GN التكاثري والهلي. يكشف EM عن أن المادة الإيجابية لـ PAS تتكون من ترتيب عشوائي (اعتلال كبيبات الليفية) أو حزم منظمة (اعتلال كبيبات الكلى المناعي) من الميكروفيلات الصغيرة والأنابيب الدقيقة ، التي لا يكون تركيبها واضحًا.
المرضى الذين يعانون من متغير immunotactoid لديهم زيادة في حدوث الأورام الخبيثة اللمفاوية. العلاج الفعال غير متوفر والعديد من المرضى يتقدمون إلى الداء الكلوي بمراحله الأخيرة أكثر من 1 إلى 10 سنوات.
التهاب كبيبات الكلى التكاثري المساري:
وتكشف العينة 5 إلى 10 في المئة من المرضى الذين يعانون من متلازمة كلوية مجهول السبب زيادة منتشرة في الخلوية الكبيبي ، ويرجع ذلك في الغالب إلى انتشار خلايا مسراق الكبيبة والبطانة ، والتسلل من قبل الخلايا الوحيدة. تختلف نتائج الفحص المجهري المناعي وتشمل IgG ، IgA ، IgM ، و / أو تكملة الرواسب أو لا توجد رواسب مناعية. من الممكن أن يكون هذا الكيان مجموعة غير متجانسة من الأمراض التي تشمل أشكالًا غير نمطية من MCD و FSGS وأشكالًا معتدلة أو حلّية من اعتلال كبيبات المناعة المناعي والمناعة المناعية. على الرغم من العلاج المثبط للمناعة ، فإن العديد من المرضى يتقدمون إلى الداء الكلوي بمراحله الأخيرة أكثر من 10 إلى 20 سنة.
اعتلال الكلية ايغا:
غالباً ما يرجع بيلة دم كبيبي عديمة الأعراض إلى اعتلال الكُلية بالجلوبيولين المناعي (IgA) أو مرض الغشاء القاعدي الرقيق (TIN) ، أو متلازمة ألبورت (Alport's syndrome). الغلوبيولين المناعي المجهول السبب (AgA) اعتلال الكلى (ايغا) اعتلال الكلية (Berger's nephropathy) تم وصفه في عام 1968 من قبل بيرغر وهينجليز. اعتلال الكُلية بالجلوبيولين المناعي (IgA) هو GN الأكثر شيوعًا في الدول المتقدمة. اعتلال الكُلية بالجلوبيولين المناعي (IgA) هو عبارة عن غلوبولين منقسم بواسطة جهاز المناعة ، مما قد يؤدي إلى الفشل الكلوي في عدد كبير من المرضى.
لا يُعرف التسبب في اعتلال الكلية بالجلوبيولين المناعي (IgA). IgA, primarily IgAl accumulates in the renal mesangial cells and leads to cytokine release, mesangial cell proliferation, and activation of alternative pathway of complement. These events ultimately damage the glomerular filtration surface.
IgA nephropathy is classified into primary (or idiopathic) and secondary forms (associated with some other known conditions). Most IgA nephropathy cases are idiopathic and the cause of primary form is not known. Consistent HLA association with IgA nephropathy has not been reported and familial clustering of IgA nephropathy is rare.
The secondary form of IgA nephropathy is associated with some other known conditions (including HSP, celiac disease, chronic ulcerative colitis, cystic fibrosis, sarcoidosis, lung cancer, pancreas cancer, HIV, toxoplasmosis, cirrhosis, SLE, Sjogren's syndrome, rheumatoid arthritis, HBV, and Crohn's disease). In many of these conditions, glomerular IgA deposition occurs without inflammation, and it may be a clinically insignificant consequence of perturbed IgA homeostasis.
IgA nephropathy and Henoch-Schonlein purpura (HNP) nephropathy are similar with respect to mesangial IgA deposition, elevated serum IgA levels, and IgA containing CICs. However, both these conditions are clinically different.
أنا. HSP occurs mostly in young children (and rare in adults) and HSP nephropathy is an acute form of glomerulitis. The presence of ANCA in HSP is proposed as a distinguishing finding between IgA nephropathy and HSP nephropathy.
ثانيا. Whereas, IgA nephropathy occurs primarily in older children and young adults and it is a chronic disorder, often leading to chronic renal failure.
Older children and young adults are predominantly affected by IgA nephropathy. There is an increased frequency of IgA nephropathy during the second and third decades of life. Men are more affected than women.
المظاهر السريرية:
The clinical presentation of IgA nephropathy varies from asymptomatic urinary abnormalities to acute renal failure.
أنا. Patients may present with asymptomatic microscopic urine abnormalities with one or more episodes of intermittent gross hematuria. The hematuria is often associated with upper respiratory tract infection (synpharyngitis), whereas, in poststreptococcal GN, the hematuria occurs 1 to 2 weeks after the pharyngeal infection. Blood pressure may be within normal range or elevated. Renal clearance function is within normal range or reduced.
ثانيا. Patients may present with asymptomatic microscopic hematuria with or without mild proteinuria, hypertension, or reduced renal clearance function.
ثالثا. Patients may present with acute nephritic features (heavy proteinuria, normal/low clearance, and normal or increased blood pressure).
د. Patients may present with nephrotic syndrome.
v. Patients may present as an acute crescentic GN with oliguria, edema, and hypertension. Spontaneous remission has been reported in children and adults; some patients have a benign course; while others develop ESRD (15 to 20% at 10 years; 30 to 35% at 20 years).
الدراسات المختبرية:
أنا. Urianalysis reveal hematuria, proteinuria, and leukocytes. RBCs and RBC casts are seen.
ثانيا. Serum IgA levels are raised in patients with IgA nephropathy.
ثالثا. Circulating IgA containing immune complexes are found.
د. Anti-streptolysin (ASO) titer or streptozyme test.
v. Diagnosis of IgA nephropathy is made by renal biopsy study. The characteristic feature in light microscopic study is mesangial enlargement produced by hypercellularity and mesangial matrix increase. Immunofluorescent study reveals a predominantly mesangial IgA deposition. Mesangial IgG, IgM, C3, and properdin deposition may also be seen. EM reveals mesangial or perimesangial deposits with a distribution similar to immunofluorescence microscopy findings.
علاج او معاملة:
The most appropriate treatment of IgA nephropathy is not known. Children with high risk of progressive disease are more likely to benefit from the treatment. Fish oil high in t5-3 fatty acids or antiplatelet agents such as dipyridamole is useful. Prophylactic antibiotic therapy and tonsillectomy may reduce the episodes and frequency of gross hematuria; however, the effects are questionable.
Corticosteroids may benefit some patients. ACE inhibitors reduce urinary protein and preserve renal function. Patients developing ESRD require dialysis or renal transplantation. Current immunosuppressive regimes do not prevent the recurrence of IgA nephropathy, which may cause graft loss. In patients with severe acute renal failure, plasmapheresis is used.
Glomerulopathy-Associated with Systemic Diseases:
There are a number of multisystem diseases in which the glomeruli are affected. The glomerular injury in the multisystem disease may be a dominant feature of the disease or relatively benign and clinically insignificant, being overshadowed by the involvement of other organs. The glomerulopathy associated with mutisystem disease are called secondary glomerulopathies.
Systemic Lupus Erythematosus:
SLE is an autoimmune disease with production of autoantibodies to a number of self-antigens. Renal functions are affected in 40 to 85 percent of patients with SLE and the renal involvement varies from isolated abnormalities of the urinary sediment to fullblown nephritis or nephritic syndrome or chronic renal failure.
أنا. Circulating immune complexes are responsible for the renal injury in most of the patients with SLE.
ثانيا. In patients with anti-phospholipid antibody syndrome thrombotic microangiopathy may be the dominant cause of renal dysfunction.
Renal biopsy from patients with SLE reveals different patterns of immune complex GN. The renal biopsy findings of SLE patients may not necessarily correlate with the clinical findings. (For example. In clinically silent lupus nephritis in which the urine analysis is normal, the renal biopsy demonstrates varying degrees of injury.)
The lupus nephritis has been categorized into six histological classifications by the WHO.
ثالثا. Class I:
Patients usually don't have clinical renal disease. The light microscopy study of renal biopsy is normal. The immunofluorescence study of renal biopsy reveals occasional mesangial deposits. Patients belonging to class I usually don't have clinical renal disease.
د. Class II (mesangial lupus nephritis):
The renal biopsy reveals prominent mesangial deposits of IgG, IgM, and C3 on immunofluorescence microscopy study and EM studies.
ا. Class IIA:
The glomeruli are normal by light microscopy.
ب. Class IIB:
Light microscopy of renal biopsy reveals mesangial hypercellularity.
ج. Microscopic hematuria and moderate proteinuria (25 to 50% of cases) occur in SLE patents under the class II category. Nephrotic syndrome is not seen and renal survival is excellent (> 90% at 5 years).
v. Class III:
Focal segmental proliferative lupus nephritis with necrosis or sclerosis affecting fewer than 50 percent of glomeruli. GFR is impaired in 15 to 25 percent of patients and one-third of patients have nephrotic syndrome.
السادس. Class IV (Diffuse proliferative lupus nephritis):
Most glomeruli show cell proliferation, often with crescent formation in light microscopy study. Other light microscopic features include fibrinoid necrosis, and 'wire-loops', which are caused by basement membrane thickening and mesangial interposition between basement membrane and endothelial cells. Immunofluorescence study shows IgG, IgM, IgA, and C3 deposits and the crescents stain for fibrin. EM reveals numerous immune deposits in mesangial, subepithelial, and subendothelial locations. Tubulo- reticular structures are frequently seen in endothelail cell. EM may reveal curvilinear parallel arrays of microfibrils with 'thumb printing' similar to those seen in cryoglobulinemia. 50 percent of patients with class II disease have nephrotic syndrome and renal insufficiency. Diffuse proliferative lupus nephritis is the most aggressive renal lesion in SLE and 30 percent of these patients progress to terminal renal failure.
السابع. Class V:
Is called membranous lupus nephritis because it has similarities with idiopathic membranous glomerulopathy. Light microscopy reveals thickening of GBM. EM reveals predominant subepithelial deposits apart from subendothelial and mesangial deposits. Approximately 90 percent of patients present with nephrotic syndrome, but significant impairment of GFR is relatively unusual.
الثامن. Class VI is characterized by diffuse glomerulosclerosis and advanced tubulointerstitial disease. Class VI probably represents the end stages of proliferative lupus nephritis. Class VI patients are often hypertensive, may have nephrotic syndrome, and the GFR is usually impaired.
Tubulointerstitial changes (such as active infiltration by inflammatory cells, tubular atrophy, and interstitial fibrosis) are seen to varying degrees in lupus nephritis and are more severe in class III and class IV, especially in patients with long-standing disease.
In patients with SLE, the renal histologic transformation from one class to another is relatively frequent.
التاسع. Class III often progresses to class IV spontaneously.
س. After treatment, class IV can transform to class II or class V.
A semiquantiative analysis can be made by using a variety of features of renal biopsy and scored 0 to 3+, an index for disease activity and chronicity. These indices have been useful in predicting response to therapy and renal prognosis in some, but not all studies.
The following serologic abnormalities are seen in patients with lupus nephritis:
الحادي عشر. Hypocomplementemia is detected in 75 to 90 percent of pafients with SLE. Hypocomplementemia is most striking in patients with diffuse proliferative GN.
الثاني عشر. ANAs are detected in 95 to 99 percent of patients with SLE and the ANAs titer tend to fall with treatment.
الثالث عشر. Changes in anti-ddDNA-antibody titers correlate with lupus nephritis activity (Almost all the patients on procainamide and 65 percent of patients on hydralazine develop ANAs; but, overt lupus, including nephritis occurs in less than 10 percent of these patients; however, anti-dsDNA antibodies are not usually detected in these patients).
الرابع عشر. Anti-Sm (17 to 30%), anti-RNP, anti-Ro (35%), anti- La (15%), are detected in patients with SLE.
الخامس عشر. 70 percent of SLE patients and 95 percent of drug- induced lupus patients have anti-histone antibodies.
Treatment of lupus nephritis is a controversial subject. Treatment is largely based on the histological class and disease activity. Correlation between clinical features (such as urinalysis, serum creatinine) and histologic classes are relatively poor. Treatment is not indicted for class I and most cases of class II lupus nephritis, because these histologic patterns suggest an excellent prognosis, (100% and > 95% at 5 year to 10 year survival rates, respectively).
Glucocorticoides and cyclophosphamide are the mainstay of therapy for patients with class III and class IV lupus nephritis. Despite maximal immunosuppression therapy, about 20 percent of aggressive lupus nephritis patients develop ESRD and dialysis is needed. After renal transplantation, recurrence of nephritis and systemic flares are very uncommon. Allograft survival rates in SLE patients are comparable to those in patients with other causes of ESRD.
Anti-phospholipid Antibody Syndrome:
Patients with anti-phospholipid antibody syndrome can develop a variable degree of renal impairment due to thrombotic microangiopathy. The thrombotic microangiopathy affects the glomerular capillaries and cause intravascular microthrombi and swelling of endothelial cells, arterioles, and interlobar arteries. Uncontrolled reports suggest that plasmapheresis is beneficial in the setting of acute renal failure secondary to thrombotic microangiopathy.
Rheumatoid Arthritis:
Direct involvement of kidney in patients with rheumatoid arthritis is rare. Glomerulopathy in RA is usually secondary to amyloid A (AA) amyloidosis or side effects of drugs used to treat RA.
أنا. 10 to 20 percent of patients with RA develop AA amyloidosis. 3 to 10 percent of these patients have clinical evidence of renal involvement and develop nephrotic syndrome and renal insufficiency. Amyloidosis is more frequent in patients with long standing disease duration (> 10 years) with circulating RF, and with destructive arthropathy. Mesangial proliferative GN and basement membrane thickening by subepithelial immune deposits may occur.
ثانيا. Gold and penicillamine therapy may cause nephrotic syndrome by inducing membranous glomerulopathy. NSAIDs can cause nephrotic syndrome by inducing minimal change nephropathy, usually in association with acute interstitial nephritis.
Gloivierular Deposition Diseases:
Abnormal proteins can deposit in the glomeruli and can cause diseases. The glomerular deposition diseases include amyloidosis, light chain deposition disease, heavy chain deposition disease, cryoglobulinemia, and fibrillary- immunotactoid GN.
Amyloidosis:
Kidneys are involved in AL and AA amyloidosis, whereas renal involvement by other forms of amyloidosis is very rare.
The clinical correlate of glomerular amyloid deposition is nephrotic range proteinuria. Furthermore, over 50 percent patients have impaired GFR at diagnosis.
أنا. 20 to 25 percent of patients present with hypertension.
ثانيا. A minority of patients present with renal failure due to amyloid deposition in the renal vasculature or with Fanconi's syndrome, nephritogenic diabetes insipidus, or renal tubular acidosis due to tubulo- interstitial involvement.
Immunofluorescence microscopy reveals usually weakly positive light chains because amyloid fibrils are usually derived from the variable region of light chains.
Most patients with renal involvement by AL amyliodosis develop ESRD within 2 to 5 years. Some success has been reported with combined melphalan and prednisone therapy. Eradication of underlying disease in AA amyloidodis may lead to remission. Recurrence of amyloidosis in the allograft is common but rarely leads to graft loss.
Light Chain-Associated Diseases:
Dr. Thomas Watson, a general practitioner observed some unusual properties in the urine of a patient whose death was certified as “atrophy from albuminuria” and whose autopsy revealed “softness of bones”.
He wrote a letter to Dr. Henry Bence Jones on November 1, 1845:
“….. The tube contains urine of very high specific gravity. When boiled, it becomes slightly opaque. On addition of nitric acid, it effervesces, assumes a reddish hue, and becomes quite clear, but as it colds, assumes the consistency and appearance which you see. Heat reliquifies it. What is it?” Since the initial report, the term Bence Jones protein is used to a urinary protein that becomes precipitated approximately at 56°C and redissolves when heated further to 100°C. The Bence Jones protein represents a homogeneous population of immunoglobulin light chains of either kappa or lambda type and is the product of a presumed single clone of plasma cells.
The light chains are filtered by the glomerulus. The filtered light chains are reabsorbed by the proximal tubular cells and catabolized by the lysosomal enzymes of the proximal renal tubular cells. Light chains appear in urine when there is markedly increased production of light chains and the ability of the proximal tubules to reabsorb the light chains is exceeded or when the proximal tubular cells are damaged.
A discrepancy between the urine dipstick test for protein and the findings from 24 hour urine protein excretion suggest the possibility of light chain proteinuria (Dipstick methods detect only albumin and they don't detect globulins). Therefore, the sulphosalicilic acid (SSA) test for urine protein should be performed to detect the light chain proteins in urine. Urine Immunoelectrophoresis using anti kappa and anti lambda sera identify the presence and nature of the light chains in urine.
The light chain polypeptides have a MW of 22, 000 KD. The kappa light chains usually occur as monomers (MW 22, 000) and hence are small enough to be filtered through the glomerulus. But lambda light chains usually exist as dimers (MW 44, 000) and hence are less likely to be filtered and appear in urine. [At times, the light chains may exist as tetramers (MW 88, 000), in which case, they are not filtered by the glomerulus and don't appear in the urine. Such patients may have light chain protinemia without light chain proteinuria.]
An individual with light chain proteinuria may live without any symptoms or the light chains may damage the kidney and cause proximal tubular dysfunction, light chain deposition disease (LCDD), cast nephropathy, AL amyloidosis, acute renal failure, or chronic renal failure.
أنا. Proximal tubular dysfunction (Fanconi syndrome):
Fanconi syndrome is a generalized dysfunction of the proximal renal tubule. Fanconi syndrome may occur as a hereditary disorder (in children) or as an acquired form in adults. Acquired form in adults is usually associated with paraproteinemias. Increased concentration of light chains exerts a toxic effect on renal tubular functions. Depending on the site of toxic effects, it may result in Fanconi syndrome or distal renal tubular acidosis, or nephrogenic diabetes insipidus.
ثانيا. Cast nephropathy (myeloma kidney):
About 50 percent of multiple myeloma patients die of renal failure. Myeloma kidney is one of the causes of renal failure in multiple myeloma. Protein casts obstructing the distal tubules and collecting tubules are observed in myeloma kidney.
ثالثا. Light chain deposition disease (LCDD):
90 percent of patients with LCDD have renal involvement. Nephrotic syndrome and renal impairment are the usual presenting features. 20 percent of patients have microscopic hematuria. Renal biopsy shows a ribbonlike thickening of the renal tubular basement membrane due to light chain deposition. Immunofluorescence microscopy reveals deposition of monoclonal light chains. LCDD associated with multiple myeloma has a poor prognosis and the patients rapidly progress to ESRD.
Waldenstrom's Macroglobulinemia:
The hyperviscosity syndrome of Waldenstrom's macroglobulinemia may compromise the renal blood flow and GFR. Direct renal involvement is rare; yet, large amorphous deposits of eosinophilic material may occur in the glomerular capillaries.
Renal Involvement in Infectious Diseases:
HIV-Associated Nephropathy:
Renal disease is relatively a common complication in patients with HIV infection. Renal disease can arise either from the direct HIV infection of kidneys or from the side-effects of drugs used to treat the HIV infection. Patients with HIV infection are at risk for developing prerenal azotemia due to volume depletion resulting from salt wasting, poor nutrition, nausea, or vomiting.
The term HIV-associated nephropathy (HIVAN; formerly known as AIDS-associated nephropathy) consists of the following five features:
1. Proteinuria
2. Azotemia
3. Normal-to-large kidneys on ultrascan imaging.
4. Normal blood pressure.
5. Focal segmental glomerulosclerosis in renal biopsy. In situ hybridization and polymerase chain reaction
(PGR) assays detect HIV-1 DNA and mRNA, which suggest that renal glomerular and tubular epithelial cells are productively infected by HIV-1. But the mechanism of renal damage in HIVAN is not known. Light microscopic findings of renal biopsy tissue are diagnostic in most cases; the glomerular capillary tuft is collapsed and may be segmentally or globally sclerosed; visceral epithelial cells are hypertrophied and form a characteristic pseudocrescent in the Bowman space.
Tubulointerstitial scarring, atrophy, and marked dilatation of the tubules (microcystic dilatation) are usually present. IFM reveals positive staining for albumin and IgG in the epithelial cells, and IgM, C3, and, occasionally IgA in the mesangial or sclerotic areas. EM shows wrinkling of the basement membrane, epithelial cell proliferation, and focal foot process effacement. Tubuloreticular structures in the glomerular endothelial cells consisting of ribonucleoprotein and membrane is highly predictive of HIVAN.
HIVAN accounts for 10 percent of new ESRD cases in US and most patients with HIVAN are young black males. The male to female ratio of HIVAN is 10:1 and the mean age of persons with HIVAN is 33 years.
HIV patients present with a nephrotic syndrome consisting of nephrotic-range proteinuria (> 3.5 gm/dl), azotemia, and hypoalbuminemia. The CD 4 count is usually below 200 cells/^.l. Patients with HIVAN are not usually hypertensive, even in the face of renal insufficiency. The urinalysis reveals proteinuria, microhematuria, leukocytes, hyaline casts, and oval fat bodies, but no cellular casts. Serum complement levels are normal. Renal biopsy is required to differentiate HIVAN from other forms of renal diseases (such as immune complex GN, IgA nephritis). The renal biopsy is usually obtained if the daily protein excretion is greater than 1 gram.
Patients with HIVAN rapidly progress to renal failure and ESRD, leading to death. However, treatment with HAART has changed the natural course of HIV disease and retarded the progression of renal disease. HIVAN should be considered in patients who are seropositive for HIV with proteinuria.
Hepatitis B Virus:
The glomerular lesions associated with hepatitis B virus (HBV) infection (Ghapter 34) include membranous glomerulopathy, MPGN, IgA nephropathy, essential mixed cryoglobulinemia, and polyarteritis nodosa. In Asia and Africa 80 to 100 percent of children and 30 to 45 percent of adults with membranous glomerulopathy have HBsAg in their circulation. HBV antigens have been identified in the renal immune deposits.
أنا. HBV antigens might have been planted in the glomerulus and subsequently, circulating HBV antibodies bind to the HBV antigens and form in-situ immune complexes in the glomerulus.
ثانيا. Circulating immune complexes containing HBV antigen might have been deposited in the glomerulus. The patients present with nephrotic syndrome and microscopic hematuria. Hypertension and renal impairment are rare. Ghronic persistent or chronic active hepatitis is the most common associated hepatic lesion. Children with HBV-associated membranous glomerulonephritis have a good prognosis and almost two thirds enter spontaneous remission within 3 years. However, 30 percent of adults develop progressive renal failure within 5 years.
Steroids and cytotoxic drugs are contraindicated, since they may lead to increased viral replication and worsen the liver disease. IFNα may reduce proteinuria and stabilize renal functions in patients with progressive disease.
Hepatitis C Virus:
Approximately 30 percent of patients with chronic HGV infection have abnormal urinary sediment. Hepatitis C virus (HGV) should be considered in all patients with cryoglobulinemic proliferative glomerulopathy, MPGN, and membranous glomerulopathy. HGV infection accounts for 10 to 20 percent of type 1 MPGN and is a major cause of essential mixed cryoglobulinemia.
أنا. Most patients with HCV present with nephrotic syndrome and microscopic hematuria; they may have red blood cell casts in the urine.
ثانيا. Liver function tests are usually abnormal.
ثالثا. C3 levels are decreased.
د. Patients are positive for anti-HCV antibodies and viral RNA is detectable in blood and cryoglobulins.
v. Renal biopsy reveals MPGN type I, and IgG, IgM, C3, and / or cryoglobulin deposits.
IFNα therapy clears antigenemia, lower cryoglobulin levels, and stabilizes the renal disease. But after discontinuation of therapy, relapse usually occurs.
Nonstreptococcal Infections Associated witli Glomerulonephritis:
The renal glomeruli may be affected during infections by the following mechanisms.
1. Circulating infectious agent-antibody complexes (circulating immune complexes) deposit in the glomerulus and activate the complement proteins, which in turn lead to the accumulation of leukocytes and platelets within the glomeruli and result in inflammation.
2. The infectious agents planted in the glomeruli may bind to circulating antibodies specific to the infectious agent and form in situ immune complexes; and, consequently, complement is activated, which in turn lead to inflammation.
3. The infection in an individual may lead to an autoimmune reaction against the glomerular antigens. The clinical presentation of infections associated with glomerulonephritis may vary from asymptomatic hematuria to full blown acute nephritic syndrome consisting of proteinuria, edema, hypertension, and renal failure.
Acute immune complex GN can occur in bacterial, viral, fungal, and parasitic infections.
أنا. Diffuse proliferative immune complex GN is a well known complication of acute and subacute bacterial endocarditis and it is usually associated with hypocomplementemia. Eradication of cardiac lesion leads to the restoration of glomerular lesions.
ثانيا. Shunt nephritis is a syndrome characterized by immune complex GN secondary to infection of ventricular shunts in hydrocephalus children. The most common bacteria of involved in shunt nephritis are coagulase negative staphylococcus.
Table 35.1: Infections causing glomerulonepliritis
بكتيريا:
Subacute bacterial endocarditis (Staphylococcus aureus is the most common bacteria), bacterial shunt infections, bacterial visceral (abdominal, pulmonary, retroperitoneal) abscesses, sepsis. Salmonella typhi, secondary syphilis (Treponema pallidum), meningococcemia, methicillin- resistant Staphylococcus aureus (MRSA).
Virus:
Hepatitis B virus. Hepatitis C virus, HIV, cytomegalovirus, parvovirus B19, hanta virus, mumps virus, measles virus, varicalla virus, ECHO viruses, Coxsakie virus.
Parasites:
Malarial parasites. Schistosomes, Leishmanial organisms, filarial worms. Toxoplasma gondii, Echinococcus granulosus
فطر:
Aspergillus Postinfection glomerulonepritis that may occur during infections are given in Table 35.1.
Antitubular Basement Membrane Nephritis:
Primary antitubular basement membrane (anti-TBM) nephritis is an exceedingly rare disease with only few reports from the world literature. In 50 to 70 percent of patients, anti-TBM antibodies were demonstrated. Immunofluorescence staining of renal biopsy tissue revealed linear deposits of IgG in the TBM. Light microscopy finding was tubular epithelial injury with a mixed chronic inflammatory infiltrates.
Secondary forms of anti-TBM nephritis are mostly associated with anti- GBM nephritis.
T Lymphocyte-Mediated Tubulointerstitial Nephritis:
T lymphocyte-mediated tubulointerstitial nephritis may occur in the following conditions.
أنا. Infections (bacterial, mycobacterial, viral, and fungal infections)
ثانيا. Drug-induced
ثالثا. Allograft rejection
د. الساركويد
Depending on the condition, the clinical presentation of T lymphocyte-mediated tubulointerstitial disease varies. In most of the cases, renal failure ensures. Light microscopy study of renal biopsy tissue shows interstitial inflammatory infiltrates. Immunofluorescenece and EM studies are not greatly helpful. Special stains and immunoperoxidase methods to identify infectious organisms may be helpful.